В исследовании MAGNITUDE изучалась комбинация нирапариба и абиратерон в сравнении с комбинацией плацебо+абиратерон в качестве первой линии терапии у пациентов метастатическим кастрационно-резистентным раком предстательной железы. В исследовании включались пациенты мКРРПЖ вне зависимости от наличия у них нарушений в генах гомологочной рекомбинации (HRR).
Какой дизайн исследования?
На этапе прескрининга всем пациентам мКРРПЖ, ранее не получавшим терапию по поводу кастрационно-резистентной формы метастатического РПЖ, проводилось молекулярно-генетическое исследование на наличие (HRR+) или отсутствие (HRR-) у них нарушений в генах HRR (ATM, BRCA1, BRCA2, BRIP1, CDK12, CHEK2, FANCA, HDAC2, PALB2). Обе когорты больных рандомизировались в 2 группы 1:1 (рис.1).
1. В первой группе больные получали нирапариб (200 мг в день) в комбинации с абиратероном 1000 мг/день
2. Во второй группе – вместо нирапариба пациенты получали плацебо в комбинации абиратероном.
Все пациенты после развития кастрационной резистентности продолжали получать андрогендепривационную терапию.
Статус HRR генов оценивался на опухолевом материале и/или плазме крови.
Рис.1 Дизайн исследования MAGNITUDE

Главная цель исследования - выживаемость без рентгенологического прогрессирования
Первичной целью исследования была оценка выживаемости без рентгенологического прогрессирования (rPFS), вторичной целью – оценка общей выживаемости, время до последующей терапии, время до симптоматического, время до ПСА прогрессирования, частота объективных ответов.
Эффективность зависела от наличия мутаций HRR
После предварительно запланированного промежуточного анализа набор в когорту HRR- был прекращен досрочно по причине низкой эффективности комбинации нирапариб+абиратерон в данной популяции больных (рис.2).
Рис.2 Отсутствие различий в выживаемости без рентгенологического прогрессирования у пациентов без нарушений в генах HRR (HRR-)
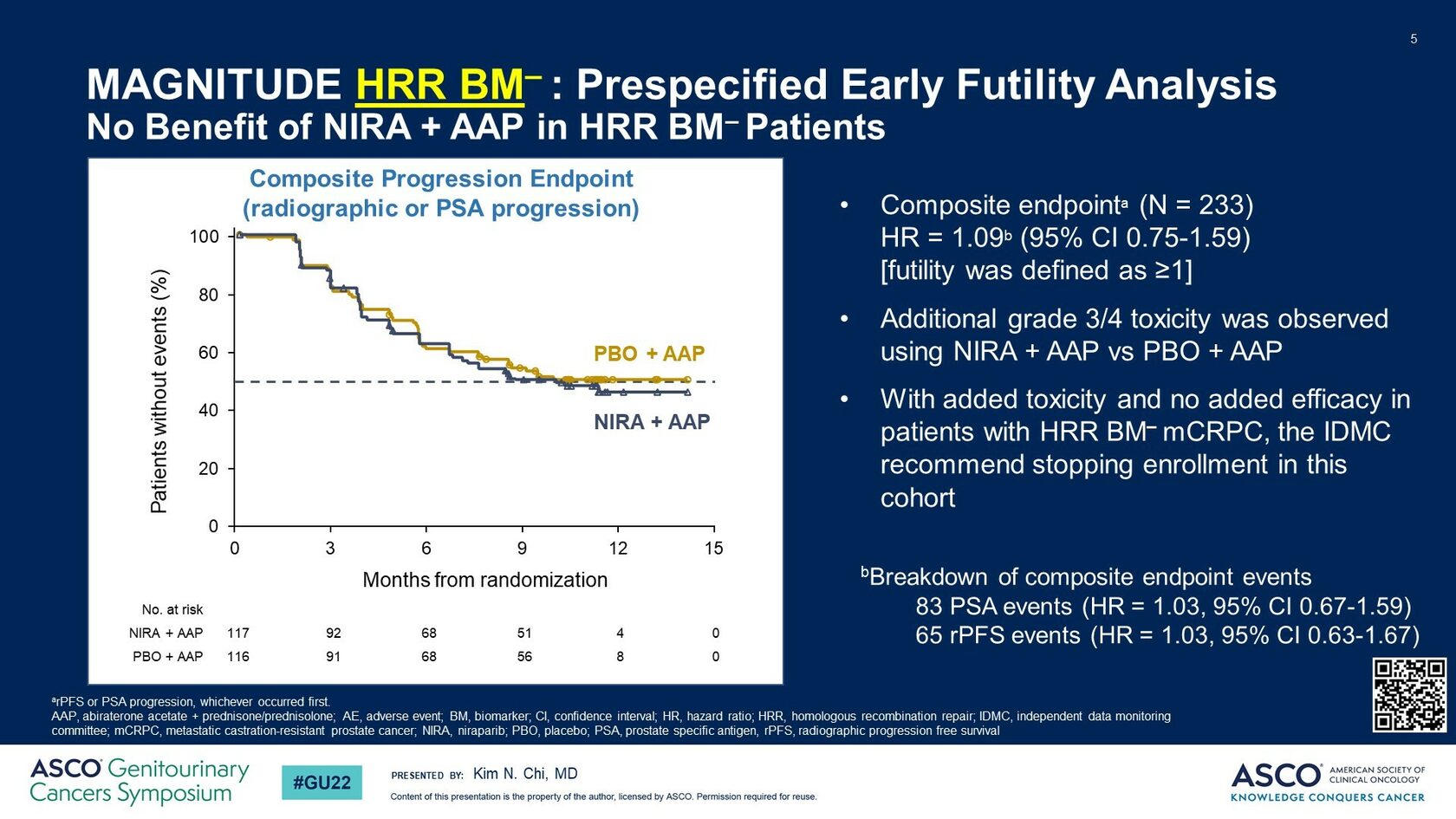
При этом набор пациентов в когорту с наличием HRR нарушений (HRR+) был продолжен и отдельно представлены результаты лечения именно для этой популяции больных. В данной когорте в основном наблюдались нарушения в генах BRCA2 (40%), BRCA1 (5%), ATM (20%) и CHEK2 (9%). Приблизительно у 83% и 21% больных выявлялись метастазы в костях и висцеральные метастазы соответственно.
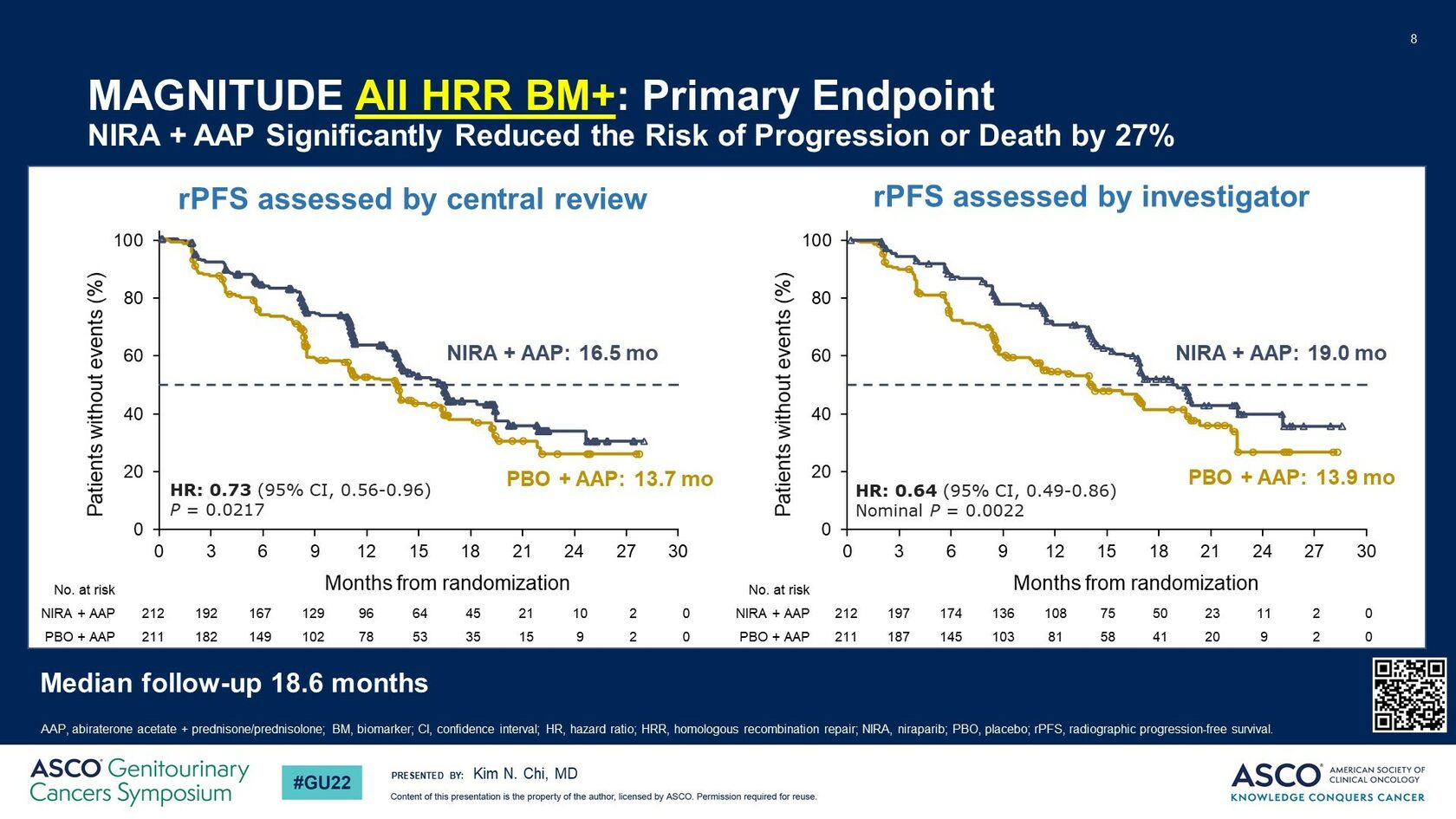
По независимой оценке добавление нирапариба к абиратерону достоверно снижало относительный риск рентгенологического прогрессирования на 27% (HR 0.73; 95% CI:0.56-0.96; P = 0.0217) и достоверно увеличивало медиану времени до rPFS с 13.7 мес. до 16.5 мес. (рис.3).
Рис.2. Выживаемость без рентгенологического прогрессирования в популяции пациентов HRR+
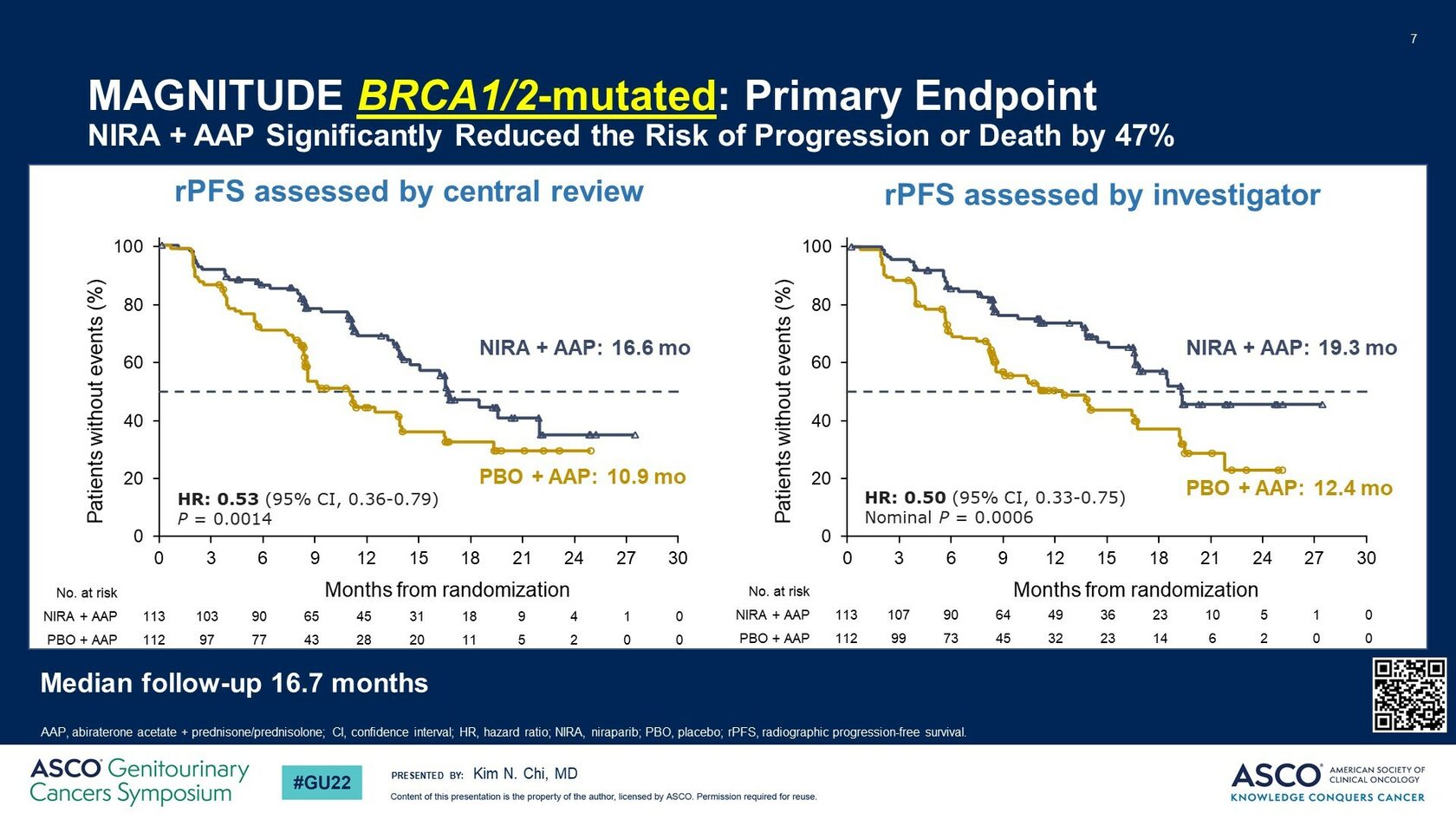
В подгруппе пациентов с наличием нарушений в генах BRCA1/2 снижение относительного риска прогрессирования было максимальным и достигло 47% (HR 0.53; 95% CI 0.36-0.79; P = 0.0014), а медиана до rPFS увеличилась с 10.9 мес. до 16.6 мес. (рис.3).
Рис.3. Выживаемость без рентгенологического прогрессирования в популяции пациентов BRCA 1/2 +
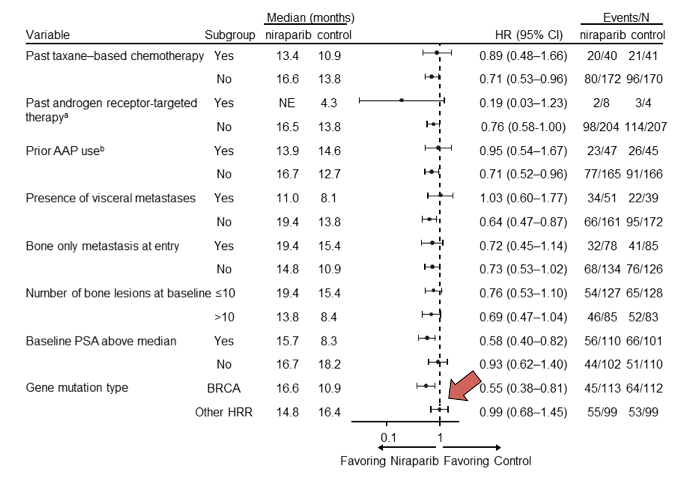
Кроме того, подгрупповой анализ не выявил достоверного увеличения времени до rPFS у пациентов с другими (non-BRCA) HRR нарушениями.
Рис.4. Подгрупповой анализ выживаемости без рентгенологического прогрессирования
Данные по общей выживаемости при медиане времени наблюдения 18.6 мес. являются незрелыми и пока не отмечается улучшение показателей ОВ в популяции HRR+ (HR 0.94 95% CI: 0.66-1.36).
Токсична ли комбинация нирапариба и абиратерона?
Частота нежелательных явлений (3-4 ст.) была выше в группе нирапариб + абиратерон (67% vs 46%), что привело к отмене нирапариба в разные сроки после начала терапии у 11% пациентов. Основным видом токсичности 3-4 ст. в данной группе были анемия (13%) и тромбоцитопения (3%).
Какие выводы сделали авторы на симпозиуме GU ASCO 2022?
Авторы сделали вывод, что добавление PARP ингибитора нирапариба к абиратерону у пациентов мКРРПЖ в качестве первой линии терапии существенно увеличивает время до rPFS во всей популяции больных с нарушениями в генах HRR при относительно хорошей переносимости. Наибольшее снижение относительного риска прогрессирования отмечено в популяции больных с BRCA1/2 нарушениями. Между тем, комбинация нирапариб+абиратерон не имеет никакого преимущества у пациентов с отсутствием HRR нарушений (HRR-).
Ограничения
Очевидно, что основным драйвером в улучшение показателей времени до rPFS при добавлении нирапариба к абиратерону в общей HRR+ популяции пациентов мКРРПЖ является подгруппа с наличием нарушений в генах BRCA1/2. Подгрупповой анализ не выявил различий в выживаемости до рентгенологического прогрессирования у пациентов с другими видами HRR нарушений. К сожалению, при небольших сроках наблюдения данные по общей выживаемости являются пока незрелыми и отсутствуют достоверные различия в общей выживаемости в популяции HRR+.
По всей видимости, с учетом значимого улучшения показателей до rPFS, пациенты с наличием BRCA1/2 мутаций пока являются именно той популяцией, которая получает максимальный выигрыш от использовании комбинации нирапариб+абиратерон в качестве терапии первой линии мКРРПЖ.
1. Kim N. Chi, Dana E. Rathkopf, Matthew Raymond Smith, Eleni Efstathiou, et al. Phase 3 MAGNITUDE study: First results of niraparib (NIRA) with abiraterone acetate and prednisone (AAP) as first-line therapy in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) with and without homologous recombination repair (HRR) gene alterations. ASCO GU 2022. San Francisco 17-19 Feb 2022. Oral Presentation
2. N. Clarke, P.Wiechno, B.Alexeev et al. Olaparib combined with abiraterone in patients with metastatic castration-resistant prostate cancer: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol 2018 Jul;19(7):975-986.
