Базовый уход за полостью рта
Базовый уход за полостью рта (BOC, basic oral care) включает рутинные действия, выполняемые пациентом или врачом для снижения бактериальной нагрузки в полости рта, предотвращения инфекций и обеспечения комфорта. Уход обычно включает механическую чистку (чистка зубов, зубная нить), полоскание ротовой полости для уменьшения накопления бактерий (мягкие полоскания), а также увлажнение и смазывание (нанесение увлажняющих средств) на поверхность слизистой оболочки полости рта.
В этой обновлённой версии рекомендаций по BOC были разделены на 5 подразделов.11:
- Обучение пациентов — образовательные мероприятия, призванные помочь пациентам понять важность ухода за полостью рта и выполнять рекомендованные правила ухода во время проведения противоопухолевой терапии (этот вид вмешательств является новым для рекомендаций);
- Протоколы многокомпонентного комбинированного ухода за полостью рта — эти протоколы служат для повышения информированности пациентов и персонала о важности соблюдения гигиены полости рта, что необходимо для уменьшения количества и тяжести осложнений со стороны ротовой полости; обычно такие протоколы включают рекомендации о времени, частоте применения и используемых продуктах, а также о различных комбинациях мягких ополаскивателей полости рта, зубных щеток и процедур чистки зубной нитью;
- Профессиональный уход за полостью рта — протоколы, осуществляемые стоматологами до или во время лечения онкологического заболевания;
- Физиологический раствор — солевые ополаскиватели сравнивали с другими типами мягких ополаскивателей и ополаскивателей с хлоргексидином (CHX);
- Натрия бикарбонат — ополаскиватель для полости рта на основе натрия бикарбоната, разведенного в воде, сравнивали с другими мягкими ополаскивателями и ополаскивателями с хлоргексидином (CHX); а также
- Хлоргексидин — ополаскиватели с CHX сравнивали с ополаскивателями плацебо, мягкими ополаскивателями для полости рта и другими ополаскивателями с активным компонентом.
Было выдвинуто несколько предположений относительно многокомпонентных комбинированных протоколов ухода за полостью рта для профилактики оральных мукозитов (ОМ) у пациентов во время химиотерапии (ХТ), лучевой терапии (ЛТ) на область головы и шеи (H&N) или при трансплантации гемопоэтических стволовых клеток (ТГСК) (таблица 1).
Таблица 1


Поскольку цель этих протоколов заключалась в повышении осведомленности о важности гигиены полости рта и улучшении соблюдения рутинных процедур BOC, а не в тестировании эффекта конкретного вещества, авторы смогли сформулировать предложение для каждой группы пациентов с онкологическими заболеваниями, несмотря на относительно небольшое количество рандомизированных клинических исследований (РКИ) для каждой категории пациентов. Кроме того, эта тенденция была подтверждена многочисленными сравнительными исследованиями.
Было высказано предложение против применения CHX для профилактики ОМ у пациентов, перенесших лучевую терапию на область головы и шеи (Таблица 1).
Для уточнения, данное руководство относится только к использованию CHX для профилактики ОМ; это не исключает применение CHX по другим показаниям, таким как профилактика или лечение инфекции полости рта. Если применение CHX показано по поводу одновременной инфекции полости рта и ОМ, его можно использовать для лечения инфекции полости рта. Новые РКИ проводились в другой популяции пациентов (ЛТ-ХТ рака H&N)19 или для другой цели (лечение ОМ, а не профилактика ОМ).20
BOC остается важной современной стратегией для пациентов, проходящих лечение злокачественных новообразований; однако, если рассматривать BOC как направление исследований, то количество данных из высококачественных, строгих клинических исследований является ограниченным. Этот тезис нашел подтверждение, когда пациенты с онкологическими заболеваниями были разделены на группы в зависимости от вида лечения. Чтобы предотвратить неправильное толкование руководства, исследователи расширили его, вынеся экспертное заключение по следующим областям: профессиональный уход за полостью рта, обучение пациентов и ополаскивание физиологическим раствором или раствором натрия бикарбоната (таблица 1). Этот подход был также использован в руководстве 2014 года. В настоящем обновленном руководстве проводится разграничение между научно обоснованными рекомендациями и заключениями экспертов.
Противовоспалительные средства
Была добавлена новая рекомендация для бензидамина12: предложение по профилактике ОМ у пациентов с опухолями головы и шеи, получающих ЛТ и ХТ (Таблица 1).
Были получены новые данные, касающиеся других противовоспалительных препаратов, таких как целекоксиб, ирсогладин малеат, мизопростол и ребамипид. Достоверных доказательств по каждому из этих препаратов было недостаточно для включения в рекомендации. Фактически, после того, как предыдущие данные были стратифицированы в соответствии с условиями и способом применения мизопростола, данных получилось недостаточно, чтобы обосновать положительную или отрицательную рекомендацию для конкретных условий применения. Таким образом, предложение 2014 года против ополаскивания полости рта мизопростолом для профилактики ОМ у пациентов с о злокачественными опухолями головы и шеи, которые получали ЛТ, было изменено на формулировку «рекомендации отсутствуют» (NGP, no guideline possible).
Фотобиомодуляция
Быстро развивающаяся область лазерной и световой терапии, в которой используется низкоуровневая энергия для стимуляции биологических реакций, получила название фотобиомодуляции (ФБМ).21 год Были опубликованы результаты большого количества РКИ и неРКИ о применении ФБМ для лечения ОМ. На определение руководства повлияли РКИ, которые соответствовали строгим клиническим и научным критериям; однако клинические исследования с более низким уровнем доказательности (LoE) также были рассмотрены и внесли вклад в рекомендацию. Исследования с невоспроизводимыми параметрами терапии ФБМ (PTP) не использовались для определения рекомендации.
Настоящее обновленное руководство содержит несколько новых идей13:
- Рекомендация по профилактике ОМ с помощью ФБМ тканей полости рта у пациентов, перенесших ТГСК (таблицы 1 и 2)13 — настоящий систематический обзор подтверждает рекомендации 2014 года в этой популяции пациентов и увеличивает диапазон параметров ФБМ, которые можно использовать22;
- Рекомендация по профилактике ОМ с помощью ФБМ тканей полости рта у пациентов, которые получают ЛТ (без ХТ) по поводу опухолей головы и шеи (таблицы 1 и 2)- это обновление рекомендаций 2014 года с изменением статуса с «предлагается» на «рекомендуется»22;
- Рекомендация по профилактике ОМ с помощью ФБМ тканей полости рта у пациентов, которые получают ЛТ и ХТ по поводу опухолей головы и шеи (таблицы 1 и 2) — эта новая рекомендация основана на последних доказательных данных.
Таблица 2. Рекомендуемые протоколы фотобиомодулирующей терапии тканей полости рта для профилактики мукозитаa
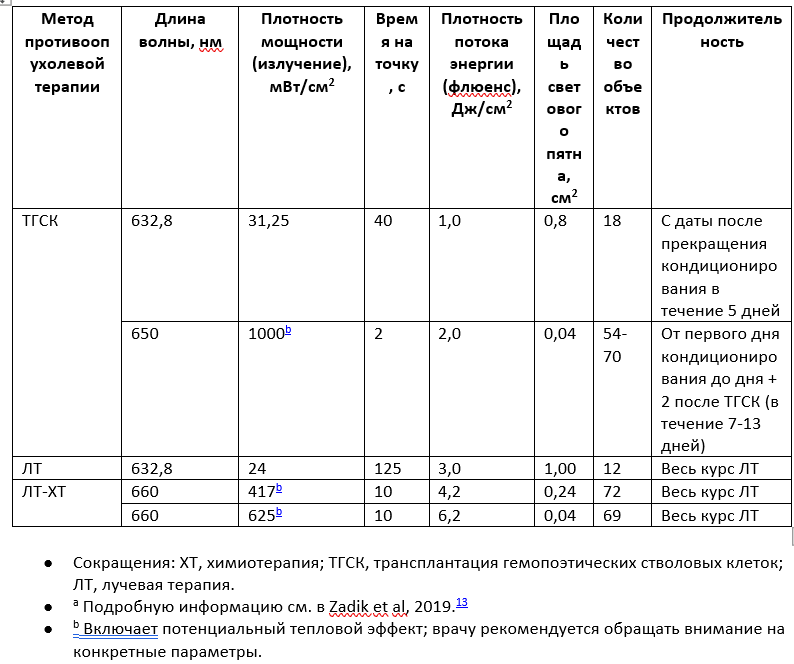
В дополнение к углублению понимания, описанному в руководстве выше, критический обзор выявил несколько высококачественных исследований, предполагающих, что ФБМ может предотвратить OM в конкретных популяциях пациентов. Эти протоколы выделены (таблица 2) с уточнением, что настройки ФБМ, упомянутые в этих протоколах, должны точно соблюдаться для оптимизации клинической эффективности. Другими словами, каждый из пяти предложенных протоколов является самостоятельным. Для конкретного пациента могут быть рассмотрены индивидуальные варианты; однако неясно, как это повлияет на клинический результат.
Авторы выявили несколько РКИ по изучению лечения ОМ у пациентов детского возраста, перенесших смешанную ЛТ/ЛТ-ХТ, смешанную ТГСК/ХТ или ХТ для нескольких типов злокачественных новообразований. Результаты были обнадеживающими; однако руководствоваться этими выводами еще слишком рано.
Ряд авторов предположили, что ФБМ может оказывать отсрочный канцерогенный эффект.13, 23 Недавние долгосрочные исследования с последующим наблюдением пациентов, получавших лечение ФБМ для профилактики ОМ, не показали увеличения частоты рецидивов злокачественных новообразований. Тем не менее, анализ этих данных является сложным.24, 25 Учитывая противоречивые данные, полученные на животных моделях о влиянии ФБМ на развитие опухоли, клиницисту рекомендуется информировать пациентов об ожидаемой пользе и потенциальных рисках ФБМ.23, 26
Криотерапия
Криотерапия приводит к вазоконстрикции поверхностных кровеносных сосудов, тем самым ограничивая доставку цитотоксических препаратов в ткани полости рта и уменьшая повреждение слизистой оболочки. Учитывая, что эффект является временным, это лечение применимо только для цитотоксических схем, которые проводятся в течение короткого времени, или для цитотоксических агентов с коротким периодом полувыведения.
Группа экспертов определила доказательства в поддержку рекомендации по 2 клиническим ситуациям (Таблица 1). Новые факты повысили уровень доказательности для ТГСК и усилили обе рекомендации 2014 года.18
Противомикробные средства, обволакивающие средства, анестетики и анальгетики
Были получены новые данные по следующим препаратам: морфин (для местного применения), сукральфат (местно/системно), флуконазол (системно), миконазол (местно и системно), мукоадгезивный гидрогель (местно; MuGard), поливинилпирролидон (местно; Gelclair), доксепин (местно) и фентанил (трансдермально).17 Новые данные подтверждают предположение в пользу морфина для местного применения (Таблица 1).17
Новые исследования сукральфата не соответствовали клиническим условиям, указанным в руководстве 2014 года. Соответственно, рекомендации против применения сукральфата для 3 клинических условий оставались неизменными. В рекомендацию было добавлено уточнение, поясняющее, что она относится к комбинированному местному применению и системному применению сукральфата (таблица 1). В отличие от этого, предыдущая рекомендация против использования сукральфата для профилактики ОМ, связанного с ХТ, была изменена в настоящих рекомендациях на формулировку «рекомендации отсутствуют» (NGP). Следует отметить, что эти рекомендации не относятся к новой лекарственной форме сукральфата, которая стала доступна в настоящее время (сукральфат полимеризованный с поперечными связями).
В предыдущем обзоре было высказано предположение в пользу полоскания полости рта доксепином и применения трансдермального фентанила. Учитывая строгие критерии, необходимые для рекомендации, и смешанную исследуемую популяцию в ряде соответствующих исследований, в обновленном руководстве формулировка была изменена на «рекомендации отсутствуют» (NGP).
Предыдущие рекомендации 2014 года против применения изеганана, полимиксина, тобрамицина и амфотерицина B (ПТА) в форме пасты; и таблеток для рассасывания бацитрацина, клотримазола и гентамицина (БКлГ) остаются без изменений, поскольку не было получено новых данных (см. вспомогательную таблицу 1).17
Факторы роста и цитокины
Были получены новые данные по следующим препаратам: фактор роста-1 кератиноцитов, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, эпидермальный фактор роста и эритропоэтин.27
Новые данные, опубликованные для рекомбинантного фактора роста-1 кератиноцитов человека, не изменили рекомендации 2014 года для этого препарата (таблица 1).28
Новые данные о гранулоцитарно-макрофагальном колониестимулирующем факторе касались новых клинических условий; поэтому предыдущая рекомендация не изменилась (таблица 1).27
Природные и прочие агенты
Были проанализированы новые данные о влиянии различных витаминов, минералов и пищевых добавок на ОМ, включая глутамин, элементную диету, цинк, полоскание перенасыщенным раствором фосфата кальция, витамин Е, селен, фолиевую кислоту и кальцитриол.
Была сформулирована рекомендация против использования глутамина (парентерально) для профилактики ОМ у пациентов, перенесших ТГСК (таблица 1).15 Изменением по сравнению с рекомендациями 2014 года было повышение уровня доказательности с II до I после публикации результатов тщательно разработанного РКИ.29 Было внесено новое предложение относительно пероральных таблеток глутамина у пациентов с опухолями головы и шеи, которые получали ЛТ-ХТ для профилактики ОМ (Таблица 1). Эта рекомендация основана на результатах 2 РКИ, показывающих, что доза глутамина от 10 до 30 мг ежедневно во время ЛТ-ХТ может предотвратить ОМ. В этой рекомендации по применению перорального глутамина упоминается отрицательное заключение по парентеральному применению глутамина и рекомендуется соблюдать осторожность в связи с более высокими показателями частоты рецидивов и смертности, зарегистрированными в 1 исследовании у пациентов, перенесших ТГСК и получавших глутамин парентерально.30
Предыдущее предложение в руководствах MASCC/ISOO 2014 года, сделанное в отношении применения цинка для пациентов с опухолями головы и шеи, которые получали ЛТ или ЛТ-ХТ, было изменено в настоящем руководстве на формулировку «рекомендации отсутствуют» (NGP).7, 15, 31
Продукты пчеловодства (мед), применяемые местно и вводимые системно, были предложены для профилактики ОМ у пациентов с опухолями головы и шеи, которые получали либо ЛТ, либо ЛТ-ХТ (Таблица 1). В некоторых РКИ популяция пациентов была смешанной (ЛТ и ЛТ-ХТ), размер выборки был небольшим и были разные источники получения меда; поэтому возможно было только высказать предположение.
Были получены новые данные по нескольким природным средствам и травам. Тем не менее, их было недостаточно для формулирования рекомендации.15
В рамках этого обновления были рассмотрены новые данные о стимуляторах слюнообразования и искусственных увлажняющих средствах.15 Смазывающее действие слюны, а также защитные белки и факторы роста в слюне (эпидермальный фактор роста и фактор роста фибробластов) могут способствовать заживлению ран. Однако, нашлось достаточно доказательств того, что жевательная резинка не эффективна для профилактики ОМ у детей с гемобластозами и солидными опухолями, получавших ХТ. В связи с этим было внесено предложение против использования жевательной резинки (таблица 1). Данное руководство не исключает использования жевательной резинки в любых других целях: стимуляция слюноотделения, ароматизатор, освежение полости рта или просто для получения удовольствия.
Предыдущая рекомендация (предложение «против применения») для пилокарпина и пентоксифиллина в конкретных условиях остаются в силе 7.
1Sonis ST, Oster G, Fuchs H, et al. Oral mucositis and the clinical and economic outcomes of hematopoietic stem-cell transplantation. J Clin Oncol. 2001; 19: 2201- 2205.
2Vera-Llonch M, Oster G, Ford CM, Lu J, Sonis S. Oral mucositis and outcomes of allogeneic hematopoietic stem-cell transplantation in patients with hematologic malignancies. Support Care Cancer. 2007; 15: 491- 496.
3Elting LS, Cooksley C, Chambers M, Cantor SB, Manzullo E, Rubenstein EB. The burdens of cancer therapy. Clinical and economic outcomes of chemotherapy-induced mucositis. Cancer. 2003; 98: 1531- 1539.
4Keefe DM, Gibson RJ, Hauer-Jensen M. Gastrointestinal mucositis. Semin Oncol Nurs. 2004; 20: 38- 47.
5Rubenstein EB, Peterson DE, Schubert M, et al. Clinical practice guidelines for the prevention and treatment of cancer therapy-induced oral and gastrointestinal mucositis. Cancer. 2004; 100: 2026- 2046.
6Keefe DM, Schubert MM, Elting LS, et al. Updated clinical practice guidelines for the prevention and treatment of mucositis. Cancer. 2007; 109: 820- 831.
7Lalla RV, Bowen J, Barasch A, et al. MASCC/ISOO Clinical Practice Guidelines for the management of mucositis secondary to cancer therapy. Cancer. 2014; 120: 1453- 1461.
8Ranna V, Cheng KKF, Castillo DA, et al. Development of the MASCC/ISOO clinical practice guidelines for mucositis: an overview of the methods. Support Care Cancer. 2019; 27: 3933- 3948.
9Somerfield MR, McCrae RR. Stress and coping research. Methodological challenges, theoretical advances, and clinical applications. Am Psychol. 2000; 55: 620- 625.
10Hadorn DC, Baker D, Hodges JS, Hicks N. Rating the quality of evidence for clinical practice guidelines. J Clin Epidemiol. 1996; 49: 749- 754.
11Hong CHL, Gueiros LA, Fulton JS, et al. Systematic review of basic oral care for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2019; 27: 3949- 3967.
12Ariyawardana A, Cheng KKF, Kandwal A, et al. Systematic review of anti-inflammatory agents for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2019; 27: 3985- 3995.
13Zadik Y, Arany PR, Fregnani ER, et al. Systematic review of photobiomodulation for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2019; 27: 3969- 3983.
14Bowen JM, Gibson RJ, Coller JK, et al. Systematic review of agents for the management of cancer treatment-related gastrointestinal mucositis and clinical practice guidelines. Support Care Cancer. 2019; 27: 4011- 4022.
15Yarom N, Hovan A, Bossi P, et al. Systematic review of natural and miscellaneous agents for the management of oral mucositis in cancer patients and clinical practice guidelines-part 1: vitamins, minerals, and nutritional supplements. Support Care Cancer. 2019; 27: 3997- 4010.
16Yarom N, Hovan A, Bossi P, et al. Systematic review of natural and miscellaneous agents, for the management of oral mucositis in cancer patients and clinical practice guidelines—part 2: honey, herbal compounds, saliva stimulants, probiotics, and miscellaneous agents. Support Care Cancer. 2020; 28: 2457- 2472.
17Saunders DP, Rouleau T, Cheng K, et al. Systematic review of antimicrobials, mucosal coating agents, anesthetics, and analgesics for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2020; 28: 2473- 2484.
18Correa MEP, Cheng KKF, Chiang K, et al. Systematic review of oral cryotherapy for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2020; 28: 2449- 2456.
19Diaz-Sanchez RM, Pachon-Ibanez J, Marin-Conde F, Rodriguez-Caballero A, Gutierrez-Perez JL, Torres-Lagares D. Double-blind, randomized pilot study of bioadhesive chlorhexidine gel in the prevention and treatment of mucositis induced by chemoradiotherapy of head and neck cancer. Med Oral Patol Oral Cir Bucal. 2015; 20: e378- e385.
20Roopashri G, Jayanthi K, Guruprasad R. Efficacy of benzydamine hydrochloride, chlorhexidine, and povidone iodine in the treatment of oral mucositis among patients undergoing radiotherapy in head and neck malignancies: a drug trial. Contemp Clin Dent. 2011; 2: 8- 12.
21 Low-Level Light Therapy. Accessed May 19, 2020. https://www.ncbi.nlm.nih.gov/mesh/?term=photobiomodulation.2020
22Migliorati C, Hewson I, Lalla RV, et al. Systematic review of laser and other light therapy for the management of oral mucositis in cancer patients. Support Care Cancer. 2013; 21: 333- 341.
23Sonis ST, Hashemi S, Epstein JB, Nair RG, Raber-Durlacher JE. Could the biological robustness of low level laser therapy (photobiomodulation) impact its use in the management of mucositis in head and neck cancer patients. Oral Oncol. 2016; 54: 7- 14.
24Antunes HS, Herchenhorn D, Small IA, et al. Long-term survival of a randomized phase III trial of head and neck cancer patients receiving concurrent chemoradiation therapy with or without low-level laser therapy (LLLT) to prevent oral mucositis. Oral Oncol. 2017; 71: 11- 15.
25Brandao TB, Morais-Faria K, Ribeiro ACP, et al. Locally advanced oral squamous cell carcinoma patients treated with photobiomodulation for prevention of oral mucositis: retrospective outcomes and safety analyses. Support Care Cancer. 2018; 26: 2417- 2423.
26de Pauli Paglioni M, Araujo ALD, Arboleda LPA, et al. Tumor safety and side effects of photobiomodulation therapy used for prevention and management of cancer treatment toxicities. A systematic review. Oral Oncol. 2019; 93: 21- 28.
27Logan RM, Al-Azri AR, Bossi P, et al. Systematic review of growth factors and cytokines for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2020; 28: 2485- 2498.
28 European Medicines Agency (EMA). Kepivance. Accessed July 28, 2019. https://www.ema.europa.eu/en/medicines/human/EPAR/kepivance
29Uderzo C, Rebora P, Marrocco E, et al. Glutamine-enriched nutrition does not reduce mucosal morbidity or complications after stem-cell transplantation for childhood malignancies: a prospective randomized study. Transplantation. 2011; 91: 1321- 1325.
30Pytlik R, Benes P, Patorkova M, et al. Standardized parenteral alanyl-glutamine dipeptide supplementation is not beneficial in autologous transplant patients: a randomized, double-blind, placebo controlled study. Bone Marrow Transplant. 2002; 30: 953- 961.
31Yarom N, Ariyawardana A, Hovan A, et al. Systematic review of natural agents for the management of oral mucositis in cancer patients. Support Care Cancer. 2013; 21: 3209- 3221.
32Bowen J, Al-Dasooqi N, Bossi P, et al. The pathogenesis of mucositis: updated perspectives and emerging targets. Support Care Cancer. 2019; 27: 4023- 4033.
33Elad S, Zadik Y. Chronic oral mucositis after radiotherapy to the head and neck: a new insight. Support Care Cancer. 2016; 24: 4825- 4830.
