Основной целью российского клинического исследования 1b фазы было определение максимальной переносимой дозы, а также дозолимитирующей токсичности внутривенного струйного введения алофаниба у пациентов с метастатическим раком желудка, устойчивым к стандартным препаратам.
Набор пациентов осуществлялся с октября 2019 года по август 2021 года. 21 пациент был включен в исследование. В исследовании приняли участие 15 (71,4%) мужчин и 6 (28,6%) женщин. 100% больных относились к европеоидной расе. Медиана возраста составила 56 лет (разброс 38 – 75). 8 (38%) пациентов были старше 60 лет, 2 (9,5%) – старше 70 лет.
5 (23,8%), 12 (57,1%) и 4 (19%) пациентов имели статус по шкале ECOG , равный 0, 1 и 2 соответственно. Таким образом, 19 (90,5%) больных имели симптомы заболевания разной степени выраженности. 14 (66,7%) пациентов были с метастазами в двух и более органах. Метастазы в печень были определены у 9 (42,9%) больных. Метастазы в кости отмечались у 3 (14,3%) пациентов. Пациенты были глубоко предлечены - количество пациентов, получивших 2 и более предшествующие линии терапии, составило 18 человек (85,7%).
Все включенные пациенты были изучены на предмет безопасности и не имели дозолимитирующей токсичности (ДЛТ) в течение 28-дневного окна оценки. У 17 (81%) пациентов было по крайней мере одно нежелательное явление, связанное с лечением (trAE). trAE степени 3 или выше (5/23,8%) включали повышенный уровень АЛТ/АСТ на дозе 50 мг/м2, нейтропению на дозе 50 мг/м2, диарею на дозе165 мг/м2, головную боль на дозе165 мг/м2, повышенный уровень амилазы в сыворотке на дозе 350 мг/м2 и реакции сразу после внутривенного введения (покраснение лица, головокружение, слабость, потливость и синусовая тахикардия) на дозе 350 мг/м2. Двое пациентов прекратили лечение из-за trAE. Наиболее частые нежелательные явления 1-2 степени включали реакции сразу после внутривенных инъекций, диарею, тромбоцитопению, артралгию и головную боль. Гиперфосфатемия 1 степени выявлена у 1 (4,8%) больного.
Предварительные результаты эффективности были удовлетворительными. В исследовании был зарегистрирован один длительный частичный ответ (продолжительность 18,53 месяца) и 12 стабилизаций болезни. Таким образом, частота контроля над болезнью составила 68,4%. Результаты общей выживаемости и выживаемости без прогрессирования представлены на рисунке.
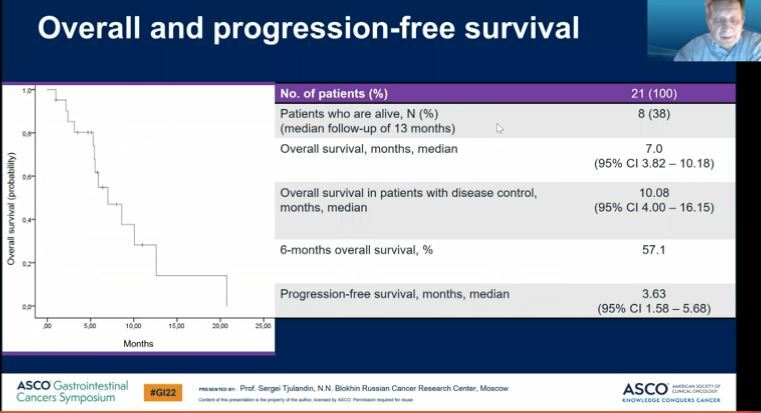
Таким образом, максимальная переносимая доза не была достигнута и доза 350 мг/м2 заявлена как доза, рекомендованная для клинического исследования 2 фазы (RP2D). Алофаниб продемонстрировал приемлемую переносимость и предварительные признаки клинической активности в поздних линиях терапии метастатического рака желудка. Рандомизированное исследование 2 фазы планируется в ближайшем будущем.
Источник: GI ASCO 2022, Tjulandin et al.
