Оставалось не совсем понятным, улучшаются ли показатели общей выживаемости и выживаемости без прогрессирования и в какой именно популяции пациенток?
Пациенты (n=1174) ранним ТНРМЖ рандомизировались 2:1 в 2 группы (рис.1).
1. В первой группе больные получали пембролизумаб (200 мг каждые 3 недели) в комбинации с неоадьювантной ХТ паклитаксел + карбоплатин (12 недель) => доксорубицин/эпирубицин + циклофосфан (12 недель) => радикальное хирургическое лечение => адьювантная терапия пембролизумабом (27 недель).
2. Во второй группе – вместо пембролизумаба пациентки получали плацебо в комбинации с неоадьювантной ХТ=> радикальное хирургическое лечение => адьювантное назначение плацебо (27 недель)
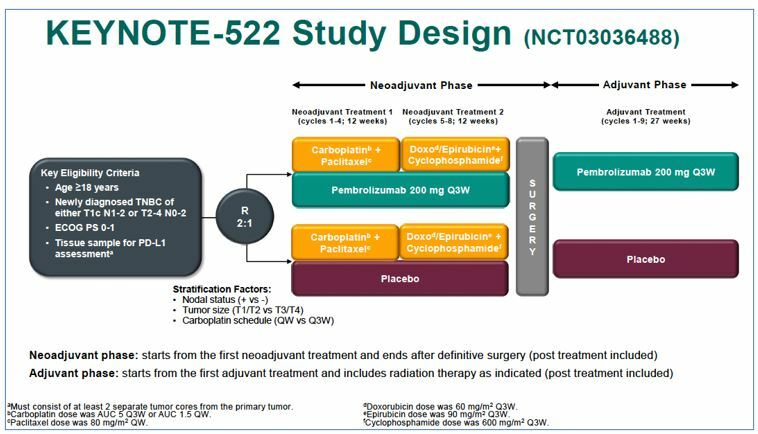
Приблизительно у 49% больных, включенных в исследование, наблюдался сN+ статус, у 74% - сT1-2 стадия и у 82% определялась PD-L1 экспрессия (CPS >1%).
Основными целями исследования была оценка частоты полных морфологических ответов, а также времени до регистрации любого события в виде локального рецидива или появления отдаленных метастазов, либо смерти от любой причины в общей популяции. Медиана времени наблюдения за больными на момент проведения анализа составила 39.1 мес.
Снижение риска рецидивов и прогрессирования
Добавление пембролизумаба к стандартной ХТ способствовало снижению относительного риска наступления любого события (появления рецидива, отдаленных метастазов или смерти) на 37% (HR 0.63; 95% CI, 0.48 to 0.82; P<0.001).
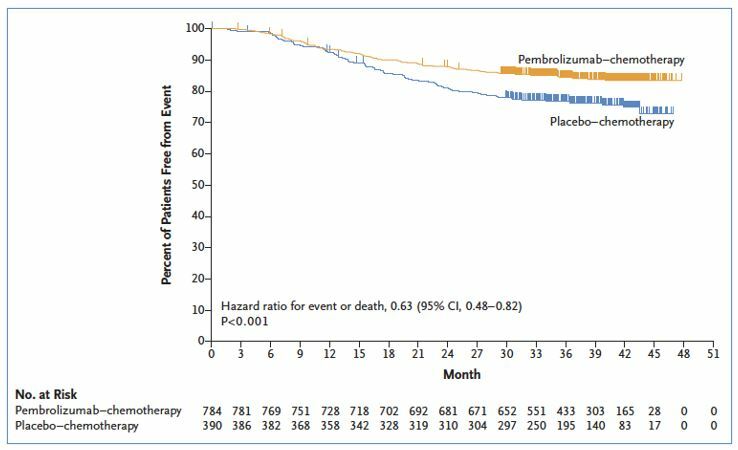
В абсолютных значениях риск развития любого события снижался на 8.1% (15.7% vs 23.8%), а риск появления отдаленных метастазов снижался на 5.4% (7.7% vs 13.1%).
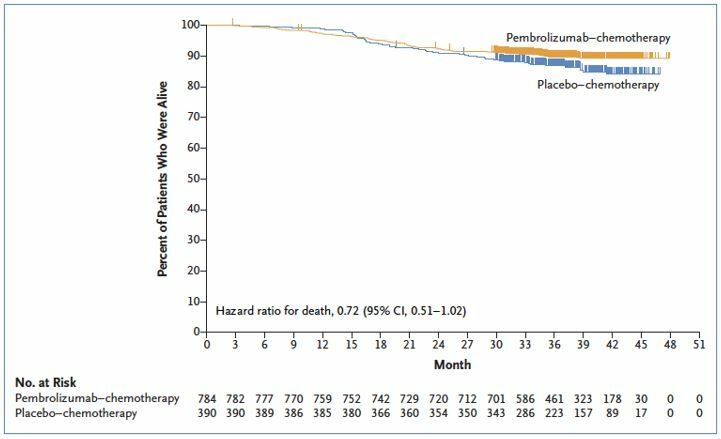
Влияние на общую выживаемость
Пока не отмечено достоверного улучшения показателей общей выживаемости, хотя эти данные являются еще незрелыми при относительно небольших сроках наблюдения за пациентами.
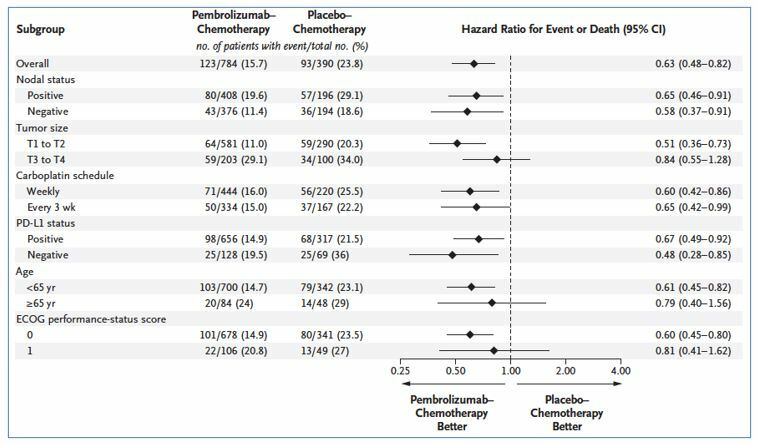
Подгрупповой анализ и частота полных патоморфологических ответов
Снижение риска наступления любого события также не зависело от уровня PD-L1 экспрессии или N статуса. При этом, в случае достижения полного морфологического ответа (pCR) после неоадьювантной терапии абсолютный риск развития рецидива или появления отдаленных метастазов в обеих группах был приблизительно одинаковым - 5.5% vs 7.4%. В то же время, в случае отсутствия pCR риск рецидива был на 11.4% выше в группе плацебо – 44.5% vs 33.1% соответственно. Данное наблюдение может указывать на то, что улучшение отдаленных результатов лечения у пациентов не достигших pCR, вероятнее всего, происходит в том числе за счет адьювантной терапии пембролизумабом после радикального хирургического лечения.
Переносимость
Несмотря на то, что общая частота нежелательных явлений 3-4 ст., обусловленных проводимой терапией, была приблизительно одинаковой в обеих группах (77% vs 73%), прекращение или перерывы в лечении на 14% чаще потребовались в группе, получавшей пембролизумаб (28% vs 14%). Частота серьезных нежелательных явлений также на 14% была выше в группе пембролизумаба (34% vs 20%), преимущественно за счет развития иммуноопосредованных осложнений в виде различых эндокринопатий: гипо- или гипертиреоидизм (20%), тиреоидит (2%), надпочечниковая недостаточность (2.6%), гипофизит (1.9%), которые развивались преимущественно на этапе неоадьювантного лечения. В 2-х случаях (0.3%) был зарегистрирован смертельный исход в результате иммуноопосредованных осложнений.
Заключение
Таким образом, результаты исследования KEYNOTE-522 продемонстрировали, что добавление пембролизумаба к стандартной ХТ в неоадьювантном режиме и его использование в адьювантном режиме после хирургического лечения у пациенток ранним ТНРМЖ увеличивает частоту pCR и достоверно снижает риск наступления любого события (появления рецидива, отдаленных метастазов или смерти) вне зависимости от уровня PD-L1 экспрессии.
Пока, к сожалению, остается не совсем понятным какие именно пациенты ТНРМЖ получат максимальную пользу от данного подхода и надо ли в случае достижения полного морфологического ответа на фоне неоадьювантной терапии после хирургического лечения проводить адьювантную терапию пембролизумабом?
1. P. Schmid, J. Cortes, R. Dent et al. Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer N Engl J Med 2022;386:556-67.
2. Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med 2020; 382: 810- 21.
