17 ноября 2021 Управление по контролю над качеством пищевых продуктов и лекарственных препаратов США (FDA) одобрило пембролизумаб для адъювантного лечения пациентов с почечно-клеточным раком (ПКР) с промежуточным или высоким риском рецидива после нефрэктомии или после нефрэктомии и резекции метастазов.
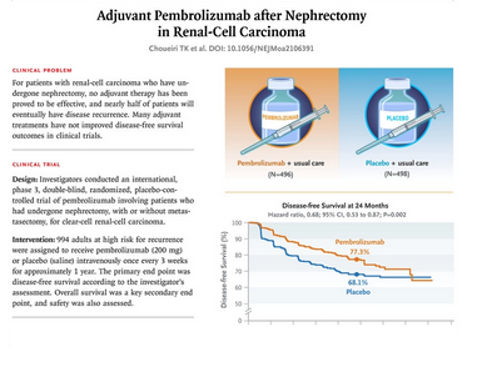
Одобрение основано на результатах многоцентрового рандомизированного (1: 1) двойного слепого плацебо-контролируемого исследования KEYNOTE-564 с участием 994 пациентов с промежуточным или высоким риском рецидива ПКР после нефрэктомии или резекции метастазов. Пациенты были рандомизированы в группу пембролизумаба 200 мг внутривенно каждые 3 недели или в группу плацебо. Лечение проводилось в течение 1 года.
Основным критерием эффективности была безрецидивная выживаемость (БВ), определяемая как время до рецидива, метастазирования или смерти. Дополнительным критерием была общая выживаемость (ОВ). Статистически значимое улучшение БВ было продемонстрировано в предварительно заданном промежуточном анализе: 109 (22%) событий в группе пембролизумаба и 151 (30%) событие в группе плацебо (ОР 0,68; p = 0,0010). Медиана БВ не была достигнута ни в одной из групп. На момент последнего анализа данные ОВ не были зрелыми, с 5% смертей в общей популяции.
Наиболее частыми нежелательными явлениями (≥20%), возникающими у пациентов в этом исследовании, были скелетно-мышечная боль, усталость, сыпь, диарея, зуд и гипотиреоз.
Рекомендуемая доза пембролизумаба составляет 200 мг каждые 3 недели или 400 мг каждые 6 недель до рецидива заболевания, неприемлемой токсичности или до 12 месяцев лечения.