Что такое тебентафасп?
Это первый представитель нового класса ImmTAC препаратов, одобренный для клинического применения. Класс ImmTAC включает биспецифические сконструированные пептиды, состоящие из части Т-клеточного рецептора, направленного на антиген, и иммунноактивирующего комплекса. Тебентафасп состоит из участка Т-клеточного рецептора, направленного против эпитопа HLA-A*02:01 белка gp100 (антигена на клетках меланомы) и активатора CD3 Т-клеток.
Эффективность оценивалась в рандомизированном открытом многоцентровом исследовании IMCgp100-202 с участием 378 пациентов с метастатической увеальной меланомой. Пациенты должны были иметь положительный генотип HLA-A*02:01, определенный с помощью центрального анализа. Пациенты были исключены, если им проводилась предшествующая системная терапия или локальная терапия, направленная на метастазы в печени. Предварительная хирургическая резекция олигометастатического заболевания разрешалась. Пациенты с клинически значимыми болезнями сердца или симптомными нелечеными метастазами в головной мозг были исключены.
Пациенты были рандомизированы (2:1) в группу тебентафаспа (N=252) или в группу терапии по выбору исследователя (пембролизумаба, ипилимумаба или дакарбазина, (N=126). Тебентафасп вводился еженедельно внутривенно капельно по 20 мкг в 1-й день, 30 мкг в 8-й день, 68 мкг в 15-й день и каждую последующую неделю до прогрессирования заболевания или неприемлемой токсичности. Основным показателем эффективности была общая выживаемость (ОВ). Дополнительным результатом эффективности была выживаемость без прогрессирования (ВБП) по оценке исследователя в соответствии с RECIST 1.1.
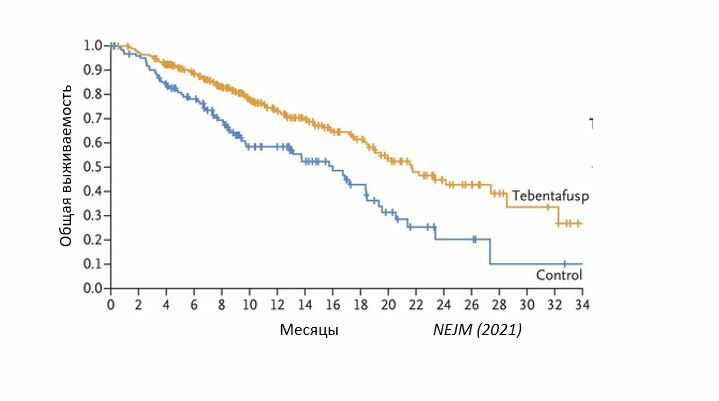
Медиана ОВ составила 21,7 месяца (95% ДИ: 18,6-28,6) для пациентов, получавших тебентафасп, и 16 месяцев (95% ДИ: 9,7-18,4) в группе терапии, выбранной исследователем (HR = 0,51, p<0,0001). Медиана ВБП составила 3,3 месяца (95% ДИ: 3, 5) и 2,9 месяца (95% ДИ: 2,8, 3) в этих группах соответственно (HR = 0,73, р=0,0139).
Наиболее частыми нежелательными явлениями (≥30%) были синдром высвобождения цитокинов, сыпь, лихорадка, зуд, утомляемость, тошнота, озноб, боль в животе, отек, гипотензия, сухость кожи, головная боль и рвота. Наиболее распространенными отклонениями лабораторных показателей (≥50%) были снижение числа лимфоцитов, повышение уровня креатинина, повышение уровня глюкозы, повышение уровня аспартатаминотрансферазы, повышение уровня аланинаминотрансферазы, снижение уровня гемоглобина и снижение содержания фосфатов.
Источник: вебсайт FDA