15 октября 2021 Управление по контролю над качеством пищевых продуктов и лекарственных препаратов США (FDA) одобрило атезолизумаб для адъювантного лечения пациентов с немелкоклеточным раком легкого (НМРЛ) II - IIIA стадии, опухоли которых экспрессируют PD-L1 ≥1% (иммуногистохимическая оценка с использованием клона SP263). Атезолизумаб назначается после резекции и химиотерапии на основе препаратов платины.
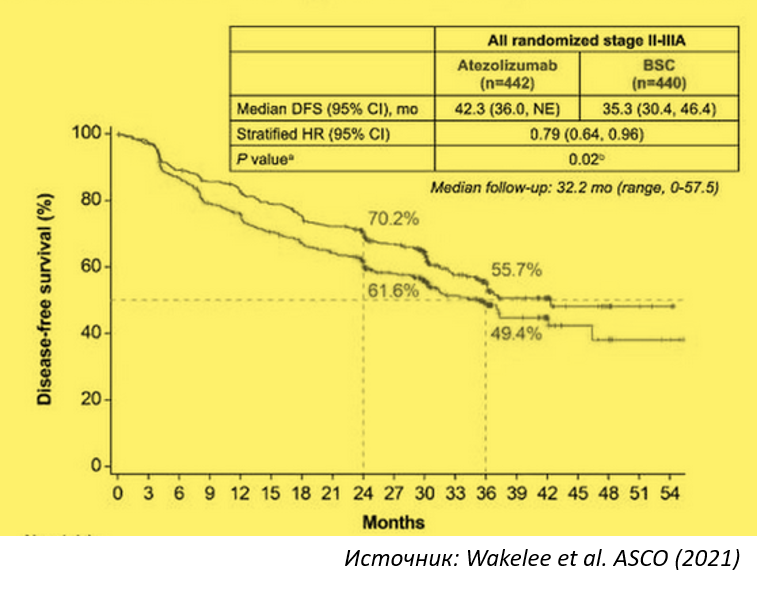
Основным критерием эффективности в рандомизированном исследовании 3 фазы IMpower010 была безрецидивная выживаемость (БВ), оцененная исследователями в первичном анализе. Пациенты с НМРЛ II-IIIA стадии с экспрессией PD-L1 на ≥1% опухолевых клеток ( PD-L1 ≥1% TC) были рандомизированы в группу атезолизумаба (N=507) и в группу наилучшей поддерживающей терапии (N=498). Медиана БВ не была достигнута (95% ДИ: 36,1 - НД) у пациентов в группе атезолизумаба по сравнению с 35,3 месяца (95% ДИ: 29,0 - НД) в группе наилучшей поддерживающей терапии (HR=0,66; p=0,004).
В предварительно запланированном анализе подгрупп пациентов с PD-L1 TC ≥ 50% НМРЛ II-IIIA стадии, HR для БВ составил 0,43. В исследовательском анализе подгрупп пациентов с PD-L1 TC 1-49% НМРЛ II-IIIA стадии, HR для БВ составил 0,87.
Наиболее частыми (≥10%) нежелательными реакциями у пациентов, получающих атезолизумаб, включая лабораторные отклонения, были повышение уровня аспартатаминотрансферазы, креатинина крови и аланинаминотрансферазы, а также гиперкалиемия, сыпь, кашель, гипотиреоз, гипертермия, усталость / астения, скелетно-мышечная боль, периферическая невропатия, артралгия и зуд.
Рекомендуемая доза атезолизумаба для этого показания составляет 840 мг каждые 2 недели, 1200 мг каждые 3 недели или 1680 мг каждые 4 недели в течение 1 года.